Trong công việc ở phòng thí nghiệm dụng cụ quen thuộc và hay được sử dụng nhất là pipet. Do yêu cầu về an toàn trong phòng thí nghiệm, cách sử dụng pipet theo phương pháp cổ điển là sử dụng mồm để hút dung dịch qua pipet đã được nghiêm cấm, thay vào đó là các loại trợ pipet bằng điện, quả bóp bằng cau su, hệ thống pipet bán tự động. Cho đến nay, có rất nhiều loại pipet nhưng có thể chia ra thành 3 loại chính: (1) Pipet pasteur bằng thủy tinh không chia vạch; (2) Pipet chia vạch bằng nhựa hoặc bằng thủy tinh; (3) Pipet bán tự động một kênh và nhiều kênh.
Để làm tốt các xét nghiệm trong phòng thí nghiệm, cần phải hiểu cách dùng và bảo quản các loại dụng cụ này, đặc biệt đối với các pipet bán tự động cần biết cách kiểm tra phát hiện những sai số của pipet để kịp thời chỉnh lý.
1. PIPET PASTEUR
Pipet pasteur chất liệu bằng thủy tinh: bình thường, đầu hút pipet thường được hàn kín bằng nhiệt, khi sử dụng phải dùng kẹp bẻ một phần đầu hút pipet rồi mới tiếp nối pipet vào quả bóp cau su hoặc trợ pipet để sử dụng. Sau sử dụng loại pipet này có thể sấy khử trùng rồi hủy bỏ, hoặc có thể rửa làm sạch, thể kéo lại đầu hút pipet và làm kín lại bằng nhiệt để tái sử dụng.
2. PIPET CHIA VẠCH
2.1. Pipet chia vạch chất liệu bằng thủy tinh (tái sử dụng sau quy trình rửa)
2.1.1. Cách sử dụng pipet với quả bóp cao su hoặc trợ pipet
– Khi hút dung dịch bằng pipet, phải chú ý cắm sâu đầu dưới của pipet vào dung dịch. Dung dịch cần hút ở trong chai nếu có thể tích lớn cần được chuyển ra một chai khác hoặc bình khác với lượng dung dịch nhỏ hơn. Phần còn lại sau khi sử dụng pipet để lấy không được đổ lại chai gốc.
– Nên hút tráng pipet hai hoặc ba lần bằng dung dịch định hút rồi mới sử dụng pipet để hút lấy.
– Khi cho dung dịch chảy từ pipet vào bình, chai hoặc ống nghiệm, cầm pipet ở tư thể thắng đứng, chạm đầu dưới của pipet vào thành bình hứng để ở tư thế nghiêng.
– Để cho dung dịch chẩy tự do xuống bình, đợi 3 giây, đầu pipet vẫn chạm vào thành bình hứng. Không sử dụng quả bóp cau su hoặc trợ pipet đẩy hết giọt cuối cùng còn đọng lại ở đầu pipet để tránh tạo khí dung.
2.1.2. Rửa pipet và các quy trình cần thực hiện để tái sử dụng
– Pipet thủy tinh sau khi sử dụng cần được sấy khử trùng, dùng kẹp nhỏ lấy bông ở đầu trên ra rồi ngâm vào dung dịch tẩy rửa đồ thủy tinh, sau đó rửa, sấy khô, đóng gói để tái sử dụng.
2.2. Pipet chia vạch chất liệu bằng nhựa đã vô trùng (sử dụng một lần): cách sử dụng như pipet chia vạch chất liệu bằng thủy tinh: lấy ra khỏi bao giấy, sử dụng, sấy khử trùng rồi hủy.
3. PIPET BÁN TỰ ĐỘNG

3.1. Cách sử dụng (pipet eppendorf) 3.1.1. Cách cầm pipet
a. Cái móc: cầm Pipet nghiêng về một phía hơi cách lỏng lẻo trên sống bàn tay khi không sử dụng, như vậy sẽ làm cơ tay ít bị quá sức.
b. Cầm chặt bằng cả bàn tay. Tránh cầm pipet quá chặt để giảm mỏi cơ tay và cơ vai sau khi sử dụng pipet lâu.
c. Để lộ phần ghi số thể tích: có thể nhìn trong suốt thời gian để có thể kiểm soát thể tích lấy ngay cả khi đang sử dụng.
d. Nút bật lớn: để một khoảng cách thuận lợi trong khoảng với của ngón tay cái và có một diện tích bề mặt rộng để làm giảm mỏi ngón tay cái.

3.1.2. Cách lấy mẫu
Phương pháp lấy mẫu có thể đa dạng tùy theo các loại dung dịch khác nhau, trên thực tế có hai cách lấy mẫu được minh hoạ dưới đây.
3.1.2.1. Cách lấy mẫu theo chiều xuôi (Forward method)

3.1.2.2. Cách lấy mẫu theo chiếu ngược lại (Reverse method)
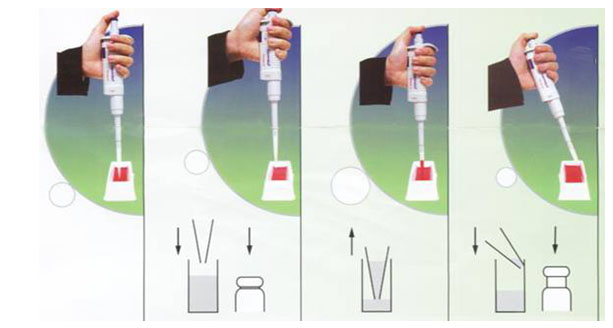
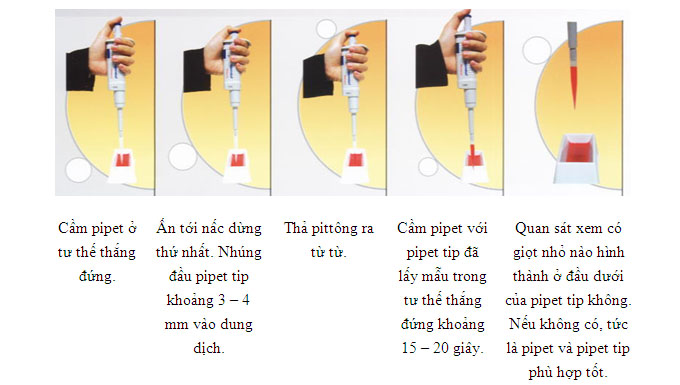
3.1.3. Kiểm tra việc lấy mẫu vào pipet tip
3.1.3.1. Kiểm tra với pipet bán tự một kênh
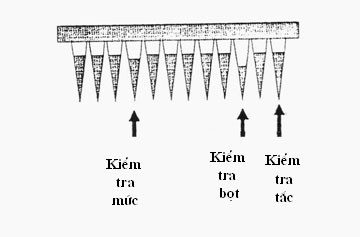
3.1.3.2. Kiểm tra với pipet bán tự động nhiều kênh
3.1.3. Cách cho mẫu
3.1.3.1. Cách cho mẫu vào ống nghiệm
Không thao tác quá nhanh tránh tạo khí dung, tạo bọt.
3.1.3.2. Cách cho mẫu vào bản nhựa
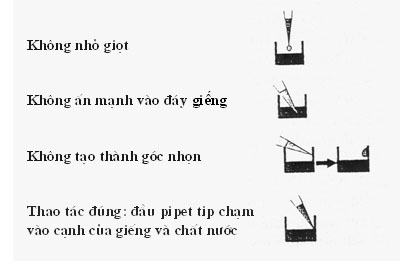
Cách cho mẫu vào các giếng của bản nhựa
3.2. Cách kiểm tra độ chính xác
– Dùng pipet hút và nhả ra 5 lần, bỏ đầu tip thứ nhất đi.
– Lấy đầu tip thứ hai hút và nhả ra 2 lần đến lần thứ 3 mới lấy để cân.
– Với mỗi một loại pipet sẽ kiểm tra độ chính xác qua 3 mức lấy mẫu: mức thấp nhất, mức trung bình và mức tối đa.
– Cân liên tiếp 10 lần, kiểm tra sai khác (yêu cầu CV < 10 %, lý tưởng là < 0,5 %. Nếu độ sai khác vượt quá 10 % cần có sự chỉnh lý lại pipet).
– Với pipet nhiều kênh phải thực hiện với từng kênh một.
Lưu ý: không cầm pipet chặt quá, vì cầm pipet lâu có thể làm nóng pipet, sẽ làm thay đổi kích thước pittông, dẫn đến sai số (có thể đi găng tay để cách nhiệt).
3.3. Cách bảo dưỡng và làm sạch pipet bán tự động (theo hướng dẫn của pipet Eppendorf, với các loại pipet khác tùy theo hướng dẫn của nhà sản xuất)
Sự lây nhiễm từ mẫu ở ống nghiệm sang pipet và từ pipet sang mẫu của ống nghiệm khác và rồi lại lây nhiễm sang pipet đã được chứng minh. Để khắc phục hiện tượng này, nhiều hang đã thiết kế ra các loại pipet tip có 2 fil lọc, hoặc các loại pipet tip có pittông để hạn chế sự lây nhiễm chéo. Tuy nhiên những loại pipet tip này giá thành rất cao.

Do vậy, thao tác làm sạch pipet sau sủ dụng sẽ hạn chế được sự lây nhiễm mẫu trong quá trình thực hiện. Sự lây nhiễm mẫu trong quá trình sử dụng pipet bán tự động khác nhau tùy theo loại chất làm lây nhiễm, do vậy cách làm sạch pipet cũng khác nhau.
3.3.1. Cách làm sạch thông thường
– Mở phần dưới của pipet.
– Tháo pittông, làm hết lớp nhờn của pittông bằng cồn 70o.
– Để pittông khô tự nhiên. Bôi một lớp mỡ mỏng và lắp ráp lại vào pipet.
– Nếu cần thiết, lau phần phần dưới của pipet bằng cồn 70o hoặc dung dịch khử trùng nhẹ, để khô trước khi lắp ráp lại vào vỏ bao ngoài của pipet.
– Khi sử dụng xong pipet cần được lau sạch toàn bộ pipet phía bên ngoài bằng cồn 70o hoặc dung dịch khử trùng nhẹ và để lên giá đỡ tránh rơi.
3.3.2. Cách làm sạch khi pipet khi hút các dung dịch lỏng, đệm, acid vô cơ và các chất kiềm
– Mở pipet. Tháo phần dưới.
– Rửa những phần bị dính hoá chất với nước cất.
– Để pipet khô (làm khô bằng không khí hoặc nhiệt độ dưới 60oC).
– Khi đã khô hoàn toàn, pittông nên được phủ một lớp mỡ mỏng. Lắp lại vào pipet.
– Khi dùng cho những chất này hoặc các chất base thông thường, nên súc rửa những phần dưới của pipet với nước cất. Có như vậy, mới làm cho pipet được sạch và tránh tạo khí dung mà nó có thể tích lũy theo thời gian.
3.3.3. Cách làm sạch pipet khi hút dung dịch có tính chất gây nhiễm tiềm tàng
– Tháo phần dưới của pipet và sấy ở 121oC trong 20 phút.
– Để tất cả các phần của pipet khô trước khi lắp ráp chúng lại với nhau. Nếu cần thiết, bôi một lớp mỡ mỏng lên pittông.
– Có thể làm bằng cách tháo phần dưới của pipet, ngâm trong dung dịch khử trùng thông thường của phòng thí nghiệm. Súc rửa kỹ lại với nước cất. Để khô, cho dầu vào pittông và lắp ráp lại.
3.3.4. Cách làm sạch pipet khi hút các dung môi hữu cơ
– Sau khi hút các loại dung môi hữu cơ khác nhau, nên mở pipet ra và để dung môi còn lưu lại tự bay hơi.
– Hoặc phần lây nhiễm của pipet có thể nhúng vào dung dịch khử trùng. Súc rửa với nước cất và làm khô.
– Cho dầu vào pittông và để khô.
3.3.5. Cách làm sạch pipet khi hút các loại protein
– Tháo pipet. Đặt phần bị lây nhiễm vào trong dung dịch đặc biệt và ủ tùy theo hướng dẫn của nhà sản xuất dung dịch.
– Súc rửa kỹ với nước cất. Làm khô và bôi một lớp dầu mỏng vào pittông.
– Tuyệt đối không sử dụng các loại cồn (alcohol) để làm sạch pipet.
3.3.6. Cách làm sạch pipet khi hút các chất có hoạt tính phóng xạ
– Tháo pipet. Đặt phần bị lây nhiễm vào trong dung dịch đặc biệt và ủ tùy theo hướng dẫn của nhà sản xuất dung dịch.
– Súc rửa kỹ với nước cất. Làm khô và bôi một lớp dầu mỏng vào pittông.
3.3.7.Cách làm sạch pipet khi hút các chất là vật liệu di truyền (Nucleic acids)
– Khử nhiễm phần dưới pipet bằng cách đun sôi trong đệm glycine/HCl (pH 2) khoảng 10 – 20 phút.
– Súc rửa kỹ với nước cất. Để khô và bôi một lớp mỡ mỏng lên pittông.
– Hoặc ngâm phần dưới pipet trong dung dịch HCl 5 – 10 % khoảng 20 – 30 phút. Súc rửa kỹ với nước cất. Để khô và bôi một lớp mỡ mỏng lên pittông.
TÀI LIỆU THAM KHẢO
- Phạm Thị Ngà. Virus viêm não Nhật Bản và các kỹ thuật chẩn đoán. Nhà xuất bản Y học. 2004: 9- 76.
- Edwin H. L., David A. L., Evelyne T. L. Diagnostic procedures for Viral, Rickettsial and Chlamydial Infection. American Public Health Association, 7th Edition 1995: 189 – 209.








